Viên nén đặc biệt và dạng bào chế hiện đại
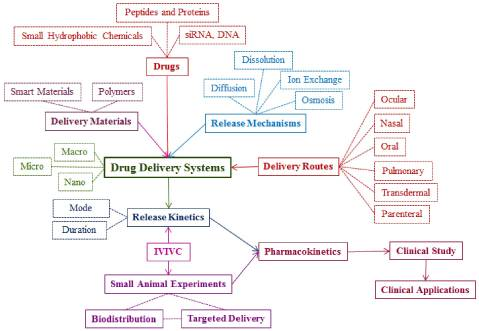
Hệ giải phóng kiểm soát
2025-03-07
Mục tiêu
- Trình bày được định nghĩa, phân loại và mô hình cấu trúc cơ bản của các hệ thuốc giải phóng kiểm soát.
- So sánh được ưu, nhược điểm của hệ thuốc giải phóng kiểm soát với hệ thuốc giải phóng kéo dài, giải phóng nhắc lại, thuốc quy ước.
- Phân tích được mô hình động học giải phóng dược chất từ dạng bào chế: mô hình động học bậc 0, bậc 1, và một số mô hình toàn học thường áp dụng.
- Giải thích được ý nghĩa của các mô hình giải phóng được chất.
Khái niệm
Khái niệm
Hệ thuống giải phóng kiểm soát (Controlled release) là các dạng bào chế có áp dụng biện pháp kỹ thuật cải biên sinh khả dụng nhằm kiểm soát chặt chẽ quá trình giải phóng dược chất trong khoảng liều có tác dụng điều trị, kiểm soát thời gian, không gian vùng giải phóng dược chất trong cơ thể, nâng cao hiệu quả điều trị của thuốc
| Đặc điểm | Dạng bào chế quy ước | Dạng bào chế hiện đại |
|---|---|---|
| Chỉ tiêu chất lương | Chất lượng của chế phẩm bào chế chủ yếu là các chỉ tiêu hóa lý | Chất lượng của chế phẩm bào chế được đánh giá chỉ tiêu giải phóng, hấp thu |
| Sinh khả dụng | SKD của thuốc gần như không cải biển | SKD cải biến như dạng giải phóng kéo dài, giải phóng kiểm soát theo chương trình, hướng đích |
| Biện pháp kỹ thuật | Áp dụng tăng độ hòa tan, tăng tính thấm | Kiểm soát giải phóng và hấp thu dược chất một cách tối ưu tạo hiệu quả điều trị cao nhất |
Lịch sử phát triển 1
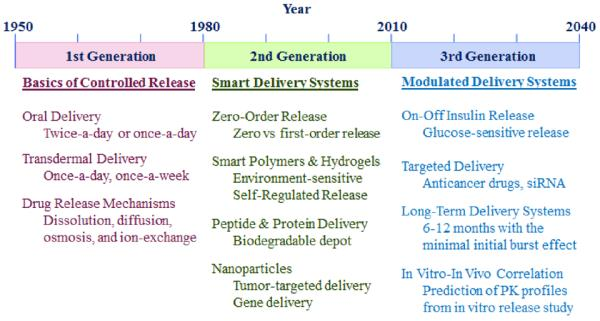
Lịch sử phát triển của dạng bào chế kiểm soát giải phóng bắt đầu từ năm 1952 với 3 thế hệ. Dextroamphetamine (A) với tên thương mại Dexedrine là thuốc đầu tiên ở dạng bào chế hiện đại thế hệ thứ nhất. Goserelin acetate (B) với tên thương mại Zoladex® Depot là thuốc đầu tiên ở dạng bào chế hiện đại thế hệ thứ hai vào năm 1989. Đây là một peptid với thời gian tác dụng kéo dài từ 1-3 tháng. Nhận thức thế hệ ban đầu làm sao cho nồng độ thuốc hằng định trong máu nhất có thể nhưng thế hệ thứ hai thay đổi sao cho nồng độ trong máu trên nồng độ có tác dụng
Ưu nhược điểm
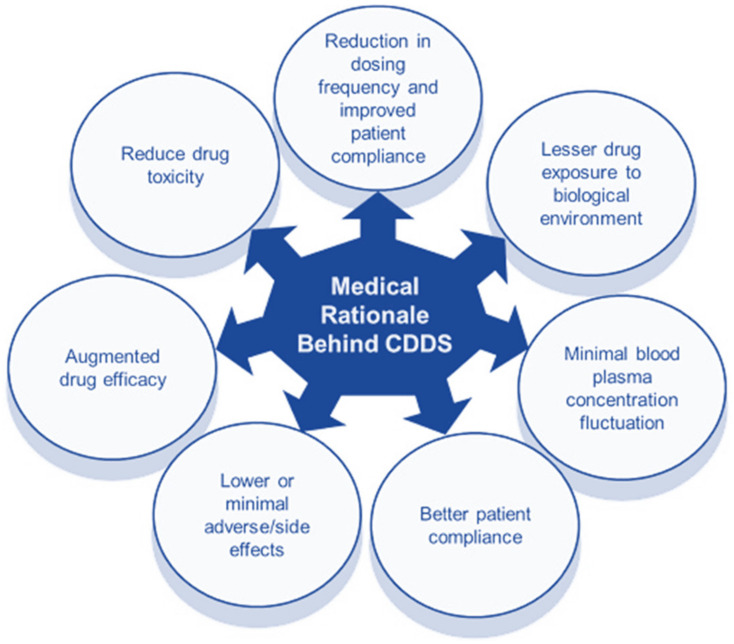
- Giảm tần suất sử dụng thuốc
- Cải thiện sự tuân thủ của bệnh nhân
- Giảm dao động nồng độ thuốc trong máu
- Giảm tổng mức sử dụng thuốc khi so sánh với liệu pháp thông thường
- Giảm tích tụ thuốc với liệu pháp mãn tính
- Giảm (cục bộ / toàn thân)
- Ổn định tình trạng độc tính y tế của thuốc (do mức độ thuốc đồng đều hơn)
- Improvement in bioavailability of some drugs because of spatial control
- Economical to the health care providers and the patient
- Minh họa về sự dẫn đầu sáng tạo / công nghệ
- Mở rộng vòng đời sản phẩm
- Sự khác biệt hóa sản phẩm
- Mở rộng thị trường
- Mở rộng bằng sáng chế
- Sự chậm trễ trong việc bắt đầu hoạt động của thuốc
- Khả năng bán phá giá liều trong trường hợp chiến lược công thức kém
- Tăng khả năng chuyển hóa lần đầu tiên
- Phụ thuộc nhiều hơn vào thời gian cư trú đường tiêu hóa của dạng bào chế
- Khả năng điều chỉnh liều kém chính xác hơn trong một số trường hợp
- Chi phí trên mỗi đơn vị liều cao hơn khi so sánh với liều thông thường
- Không phải tất cả các loại thuốc đều phù hợp để pha chế thành dạng bào chế ER
Phân loại
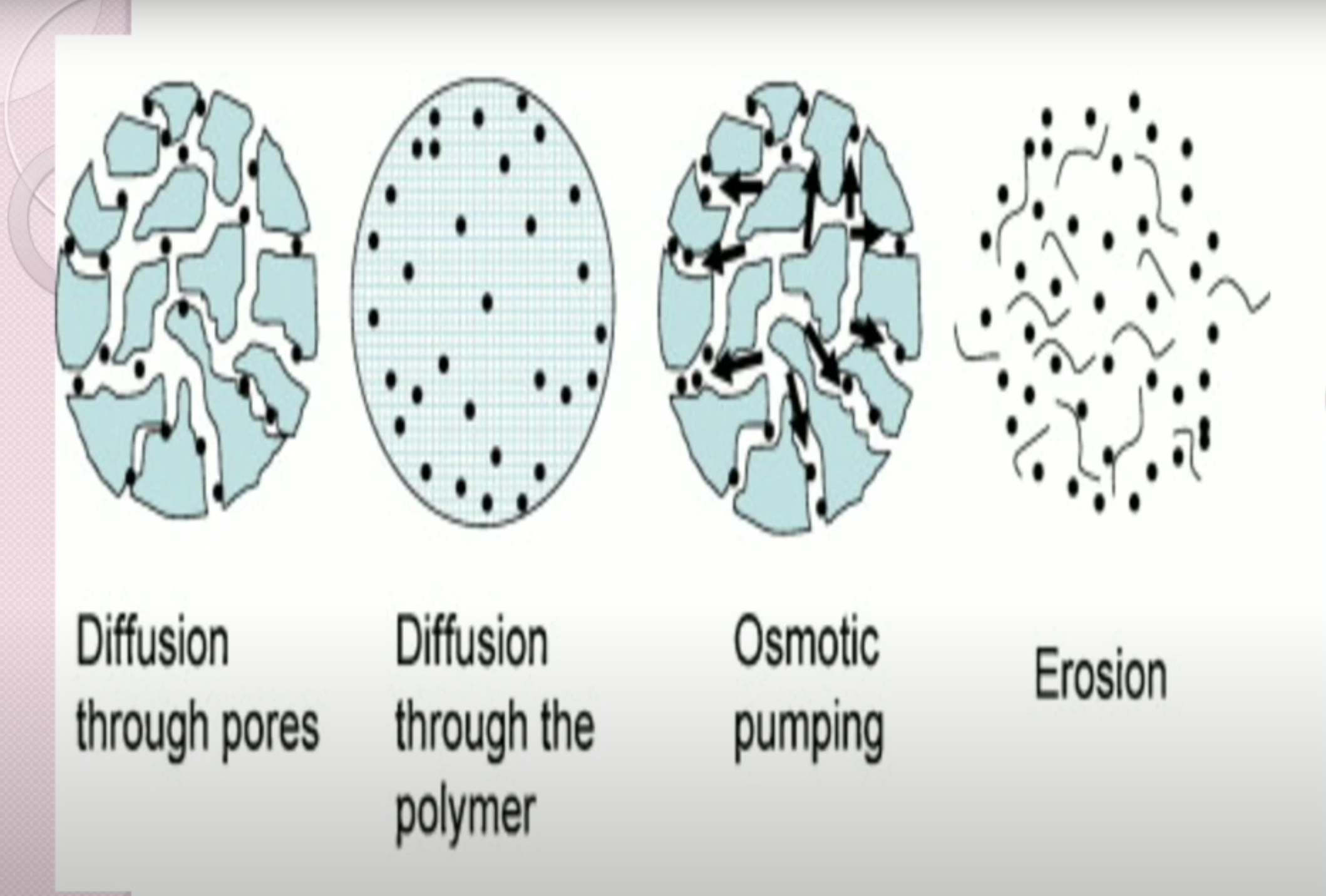
Thế hệ đầu tiên 1950 đến 1980 sử dụng cơ chế kiểm soát hòa tan, khuếch tán, áp suất thẩm thấu và trao đổi ion dùng dạng đường uống và hệ trị liệu qua da
Thế hệ thứ hai sử dụng qua đường tiêm: Với công thức vi hạt sử dụng poly(lactic-co-glycolic acid) (PLGA) nhằm cung cấp giải phóng peptide và protein trong vòng 1 tháng. Thuốc có thể kéo dài trong 6 tháng nếu điều chỉnh tỷ lệ và protein. Một cách tiếp nữa chính là poly (ethylene glycol) (PEG) vào các phân tử protein — PEGylation. Điều này giúp protein tồn tại lâu hơn trong cơ thể. Tuy nhiên nhược điểm cơ thể sẽ sinh ra kháng thể chống lại phân tử PEG dẫn đến quá trình thanh thải nhanh hơn.
Tiến bộ gần đây: 2021, GlaxoSmithKline và ViiV Healthcare công bố phát triển thuốc điều trị HIV siêu dài dựa trên enzyme hyaluronidase PH20 tái tổ hợp ở người (rHuPH20). Johnson & Johnson, và Bioasis Technologies, đã được hình thành để phát triển các loại thuốc có thể vượt qua hàng rào máu não (BBB).
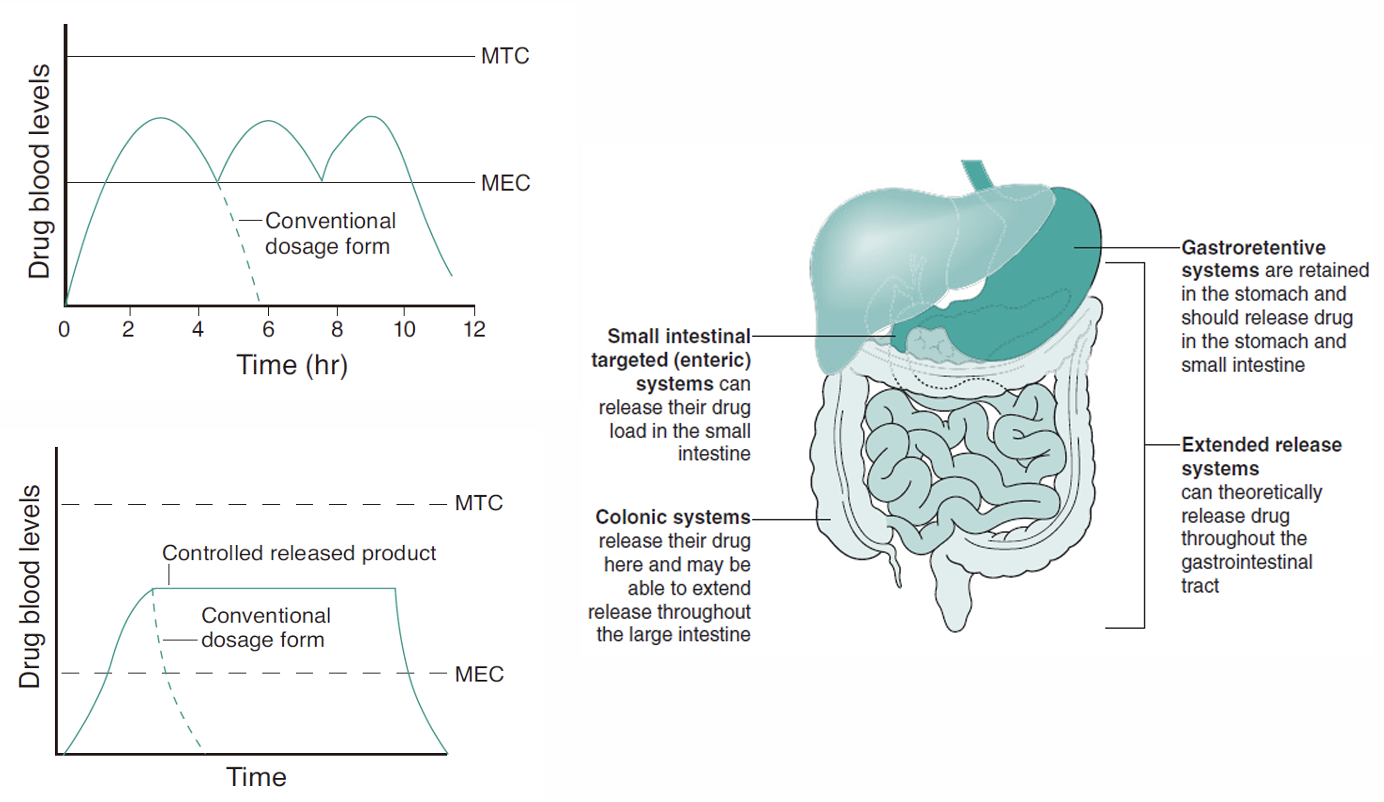
| Mô hình giải phóng | Thời gian giải phóng | tên gọi dạng thuốc |
|---|---|---|
| Giải phóng ngay (Immediate release) | trong vòng 30 phút | Thuốc quy ước |
| Giải phóng nhanh | Trong vòng 1 phút | Thuốc giải phóng nhanh |
| Giải phóng muộn (delay release) | Trong vòng 1-2 giờ | Bao tan tại ruột |
| Giải phóng sau 3-5 giờ | Giải phóng theo nhịp sinh học | |
| Giải phóng kéo dài (Extended release) | trên 60 phút | Thuốc giải phóng kéo dài |
| Giải phóng kiểm soát nồng độ dược chất trong máu hằng định trong khoảng điều trị (Timed release) | Hàng ngày (12-24 giờ) | thuốc giải phóng kiểm soát |
| Giải phóng theo chương trình | Hàng tuần, hàng năm | Hệ điều trị, hệ trị liệu |
| Giải phóng tại đích (targeted release) | Hàng ngày, hàng tháng | Thuốc giải phóng tại đích |
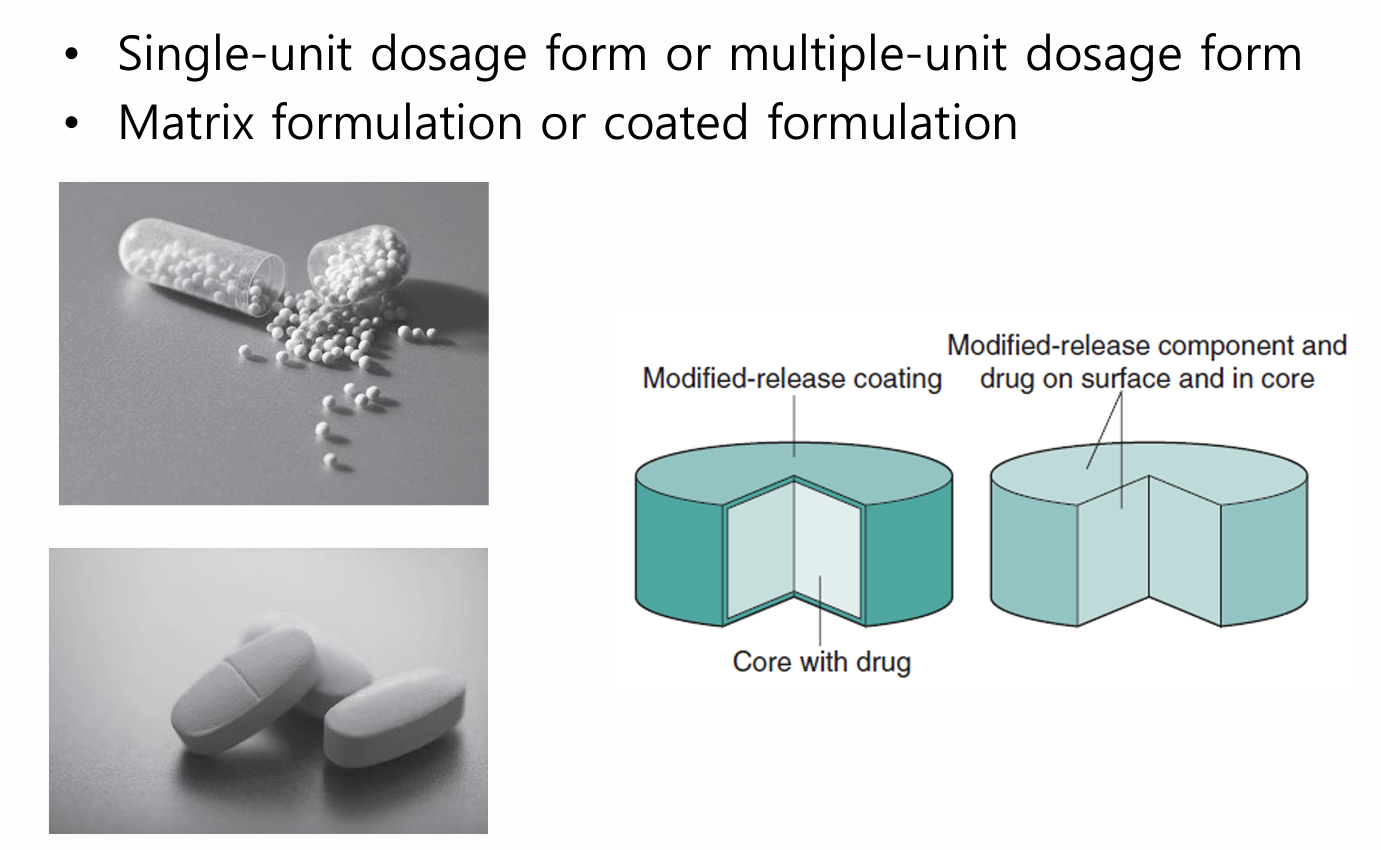
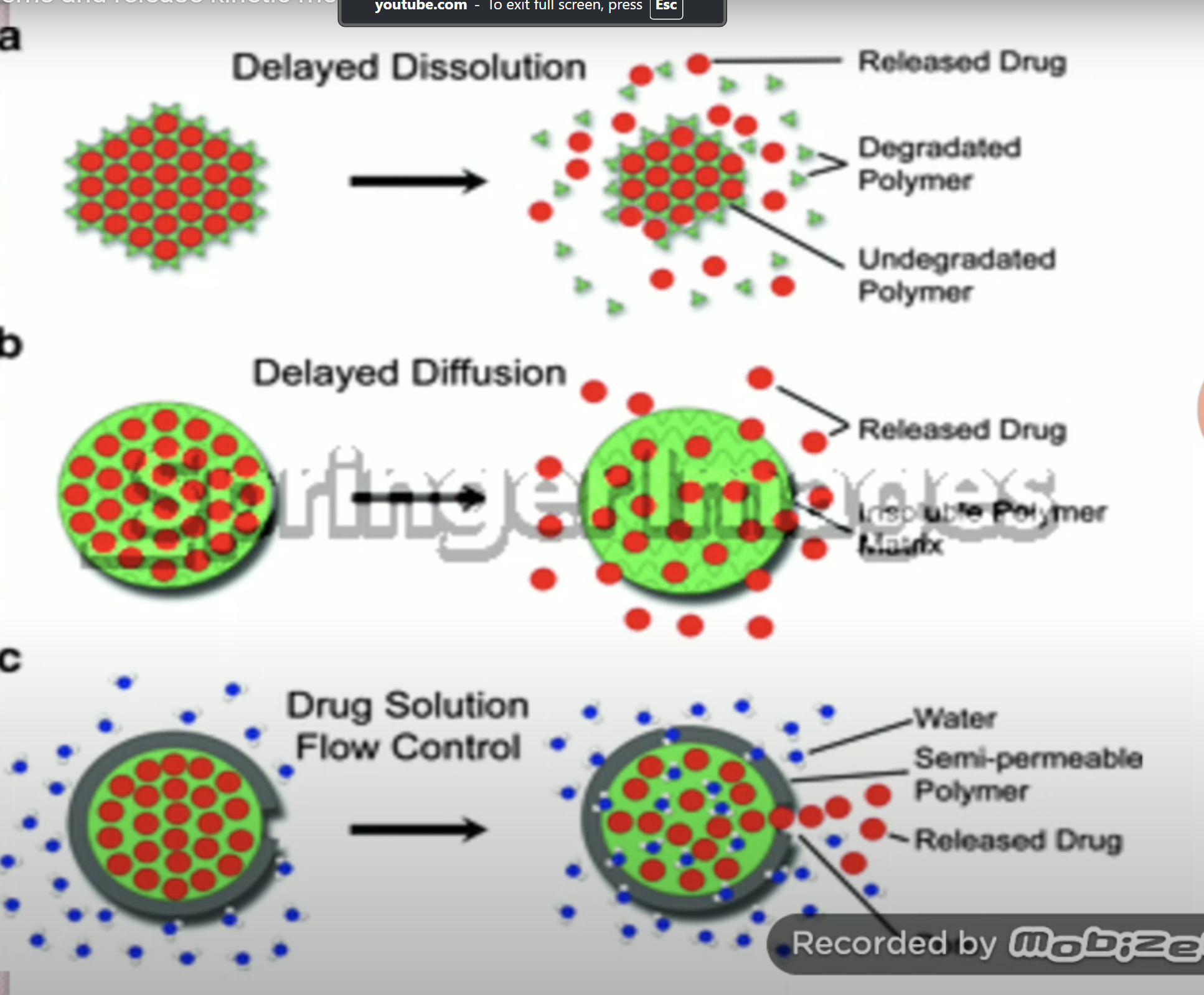
Hệ cốt kiểm soát giải phóng: Hệ thuốc dược chất phân tán đồng nhất trong cấu trúc cốt
- Hệ cốt không tan trong dịch sinh học
- Hệ cốt hòa tan ăn mòn trong dịch sinh học
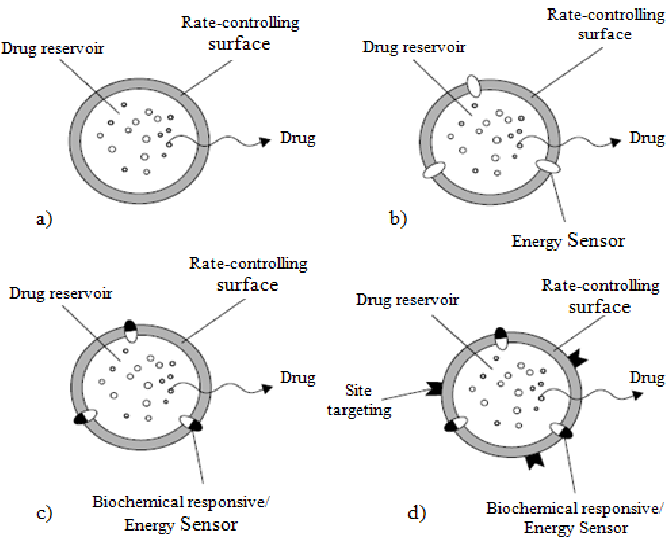
Hệ màng bao kiểm soát giải phóng
- Hệ màng bao không tan trong dịch sinh học, kiểm soát sự giải phóng dược chất nhờ kênh khuếch tán có trong cấu trúc màng
- Hệ màng bao hòa tan ăn mòn trong dịch sinh học, kiểm soát sự giải phóng dược chất nhờ lớp gel do màng bao tạo ra, có mạng lưới polymer trương nở hòa tan, có độ nhớt cao và bị ăn mòn dần
Hệ kết hợp cốt-màng, hệ nhiều vi hệ
Thuốc kiểm soát giải phóng có cấu bơm thẩm thấu
- Hệ thuốc chứa dược chất được bao màng bán thấm
Thuốc giải phóng dược chất theo nhịp sinh học
| Type of material | Type of device | Loaded drug | Burst release | Release kinetics | Transport mechanism |
|---|---|---|---|---|---|
| Segmented PU (Cardiomat 610) | Drug-eluting stent | 1,3-Dipropyl-8-cyclopentyl xanthine | 1 d | Near linear release (~ 20 d) | Non-Fickian diffusion |
| Elast-Eon™ | Drug-eluting stent | Dexamethasone acetate | w/ | Biphasic pattern | Fickian diffusion |
| Polyurethane (Walopur®) | Disk-shaped matrices | Flucloxacillin-Na, Fosfomycin, Gentamicin-base | 1 d | Near linear (2 ~ 5 d) | Matrix-controlled |
| Poly(urea-urethane) | Microcapsule | Auramine (Oil-soluble dye) | w/o | Near linear (~20 min) | Non-Fickian Diffusion |
| PEG modified polyurethane | Dermal patch | Thiamazole, diclofenac sodium, ibuprofen | 12 h | Biphasic pattern (~ 48 h) | - |
| PDMS | Rod (matrix vs. reservoir) | Ivermectin | w/o | Matrix: first order, 50 d; Reservoir: zero order, 84 d | Matrix: diffusion, Reservoir: case II transport |
| PDMS | Intravaginal ring (reservoir) | TMC120 | 1–2 d | Biphasic; near zero order release for 30 d | Case II transport |
| PDMS | Intravaginal ring (core-type) | TMC120 | w/o | Zero order, 71 d | Case II transport |
| PDMS | Strip (10×20 mm) | Metronidazole | w/ | Higuchi (linear vs. t1/2) | Fickian diffusion |
| PEVA (VA content, 40%) | Membrane | Quinupramine | w/ | Higuchi (linear vs. t1/2) | Fickian diffusion |
| PEVA | Thin film | Acyclovir, Chlorhexidine diacetate | w/o | Near zero-order (~ 8 d) | Non-Fickian diffusion |
| PEVA | Drug-eluting stent coating | 5-Fluorouracil | w/ | Biphasic pattern (~20 d) | Fickian diffusion |
| PEVA (VA content, 40%) | Disk-shape Film | Chlorhexidine diacetate | w/ | Near-zero order (~ 7 d) | Non-Fickian diffusion |
| PEVA (VA content, 40%) | Membrane | Furosemide | w/ | Higuchi (linear vs. t1/2) | Fickian diffusion |
| Dextran sulfate | Microcapsule | Insulin | w/ | Biphasic pattern (~12 h) | Fickian diffusion |
| Methacrylated dextran | Hydrogel | Vitamin E | ~3 h | Biphasic | Swelling |
| HPMC with β-CD | Tablet | Difunisal | w/o | Zero-order for nonsoluble β-CD; First-order for soluble β-CD | Non-Fickian diffusion |
| Type of material | Type of device | Loaded drug | Burst release | Release kinetics | Transport mechanism |
|---|---|---|---|---|---|
| PLGA/PLA | Microparticle | Diltiazem hydrochloride | 2h | Triphasic pattern | Diffusion and erosion |
| PLGA | Nanoparticle | Estradiol | w/o | Zero order up to 31 ~54 d | Diffusion-cum-degradation |
| PLGA | Microcapsule | Insulin | 20%, 24h | Triphasic pattern | Diffusion and erosion |
| p(FAD-SA) 50:50 | Implantable disk | Cefazolin sodium | w/o | 100%, 14 d | Diffusion |
| Bupivacaine free base | w/o | 90%, 35 d | Diffusion and degradation | ||
| Taxol | w/o | 15%, 77d | Degradation | ||
| PEG hydrogel with degradable crosslinks | Disk | Bovine serum albumin | w/o | Zero order in the presence of human neutrophil elastase | Triggered degradation |
| Poly(ortho ester amide) copolymer | NA | FITC-dextran | w/o | Near zero order | Erosion |
| HPMC | Tablet | Adinazolam mesylate | w/ | Near zero order, 10h | Swelling and dissolution |
Ưu nhược điểm
- Bào chế quy ước
- Dạng kiểm soát
- So sánh hai dạng
- Thuốc giải phóng kéo dài
- Thuốc giải phóng nhắc lại
- Thuốc giải phóng kiểm soát
- Lựa chọn hoạt chất 1”
| Ưu điểm | Nhược điểm |
|---|---|
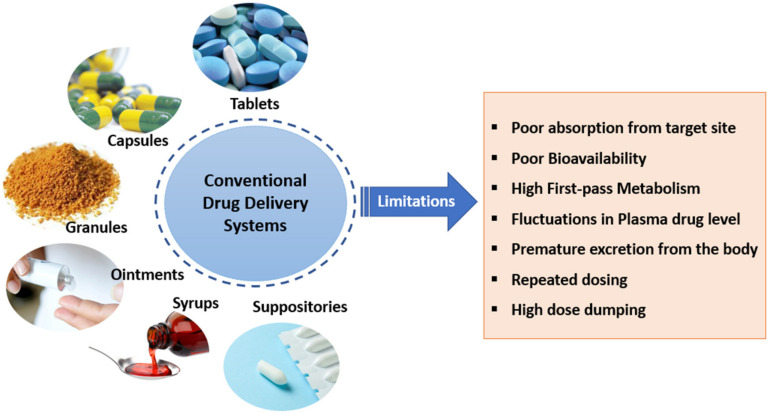
| Thuận tiện trong quản trị | Hấp thu kém từ vị trí dùng |
| IVIVC không xâm lấn và tốt hơn | Không có đích tác dụng |
| Dạng bào chế đơn vị chính xác và đo lường | Bài tiết sớm ra khỏi cơ thể |
| Thời hạn sử dụng cao hơn | Chuyển hóa thuốc sớm |
| Thích ứng với sự thay đổi của bệnh nhân | Sinh khả dụng kém |
| Linh hoạt để bác sĩ điều chỉnh liều lượng | Liều lượng lặp lại |
| Chi phí thấp | Tuân thủ bệnh nhân kém |
| Ưu điểm | Nhược điểm |
|---|---|
| hoạt chất giải phóng ra có kiểm soát hoặc xác định | Độc tính có thể xảy ra với tá dược được sử dụng |
| Tính đặc hiệu của mục tiêu | Có quá liều |
| Thời gian giải phóng kéo dài | Có thể có hiện tượng sinh ra kháng thể đào thải tá dược |
| Bảo vệ khỏi sự trao đổi chất bằng enzyme/hóa chất | Sự hấp thụ của RES làm giảm hiệu quả |
| Cải thiện sinh khả dụng | IVIVC kém hơn |
| Tần suất sử dụng thuốc giảm | Hạn chế các hoạt chất chuyển sang dạng này |
| Tuân thủ bệnh nhân tốt hơn | Chi phí sản xuất cao hơn |
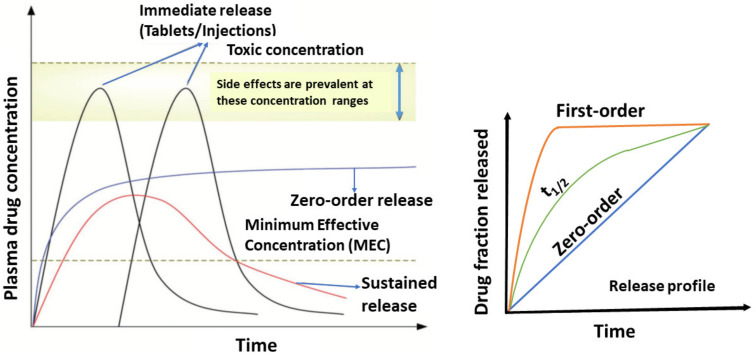
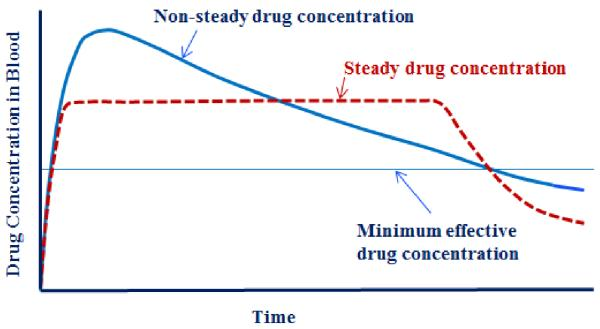
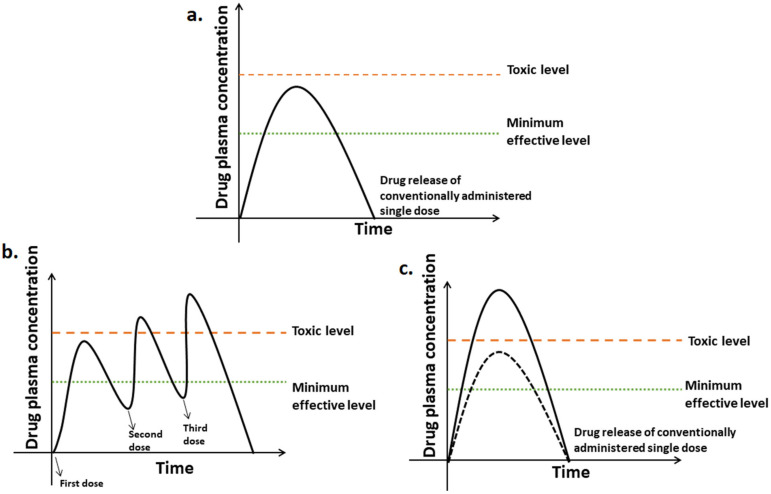
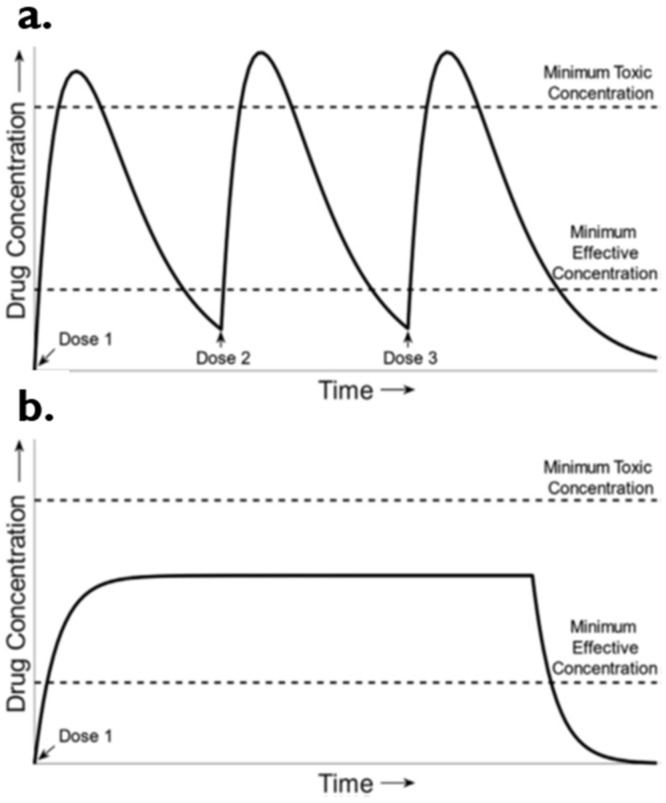
Nhược điểm của thuốc quy ước chỉ tạo 1 liều điều trị trong khoảng thời gian có tác dụng và nồng độ trong máu có thể vượt ngưỡng gây độc. Phải dùng nhiều lần trong ngày.
Nhược điểm của GPKG người bệnh phải tuân thủ theo phác đồ không chia viên, không nghiền vỡ viên. Kỹ thuật sản xuất cao đòi hỏi tính chính xác. Chỉ một số dược chất có thể sản xuất được.
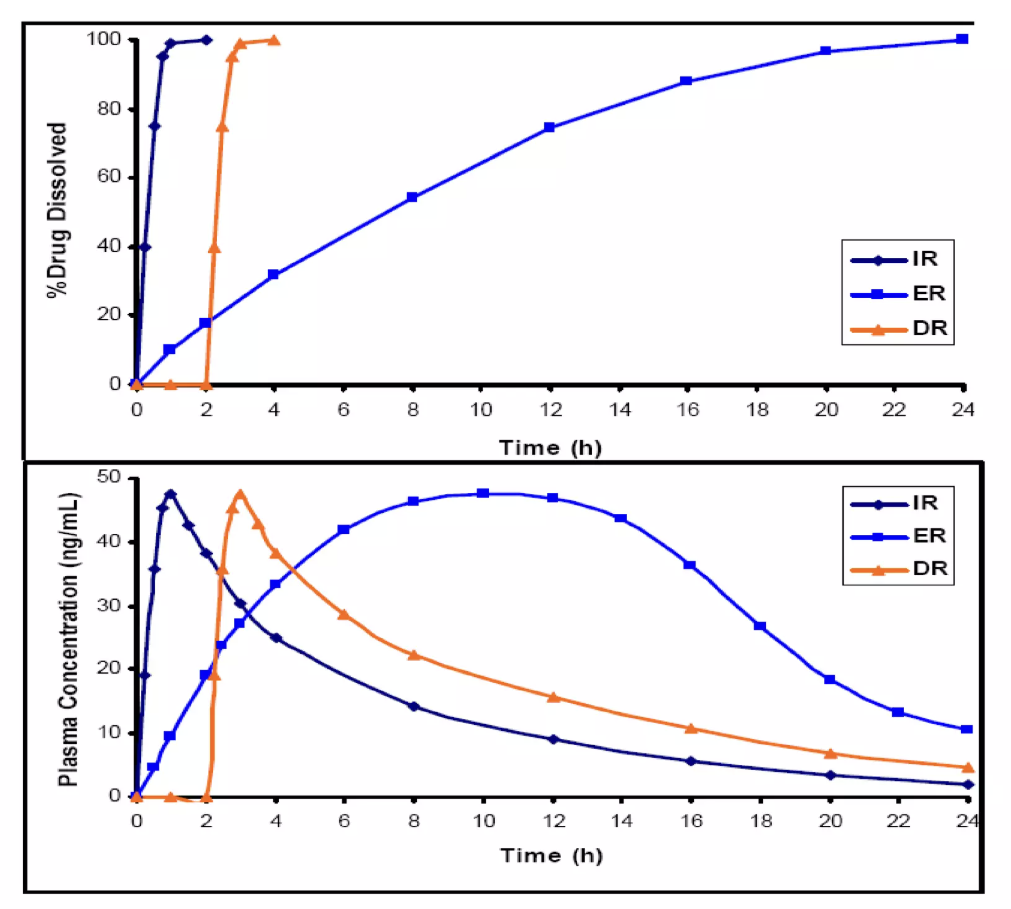
extended-release (ER)
Ưu điểm: Nồng độ máu được duy trì trong khoảng liều có tác dụng với thời gian dài, giảm số lần dùng thuốc cho người bệnh, giảm tác dụng không mong muốn, nâng cao hiệu quả điều trị của thuốc.
- Thuốc giải phóng thời gian dài: hơn 60 phút do với dạng quy dược
- Thuốc giải phóng kéo dài: 8h, 12h,24h
- Thuốc giải phóng duy trì: giải phóng nhanh có tác dụng ban đầu, sau đó duy trì nồng độ hoạt chất trong máu
Nhược điểm: Định đỉnh và đáy không hằng định
Ưu điểm: Nồng độ giải phóng ngắt quãng sau khoảng thời gian nhất định, duy trì trong máu nhưng không hằng định
Nhược điểm: Thuốc được giải phóng ngắt quáng, nống độ duy trì trong máu nhưng không hằng định tạo ra đỉnh và đáy theo chu kỳ. Tạo cảm giác khó chịu
Sustained Drug Delivery System Ưu điểm: Nồng độ dược chất hằng định trong máu tại liều điều trị tối ưu trong thời gian dài, không tạo hiện tượng đỉnh và đáy
Khối lượng phân tử: 150-400
Molecular weight or size: Phân tử cần đi qua khe màng; khối lượng 150 sẽ ở dạng hình cầu, trong khi 400 sẽ ở dạng chuỗi.
Dạng không ion hóa chiếm từ 0.1 - 1% thuốc
Solubility: Cần thử độ tan của hoạt chất ở các pH khác nhau. Hoạt chất có độ hòa tan dưới 0.1 \(\mu g/ml\) ở pH acid có sinh khả dụng không ổn định và giảm. Khi độ hòa tan dưới 0.01 \(\mu g/ml\), sự hấp thu sẽ bị ảnh hưởng mạnh bởi khả năng hòa tan.
Hệ số phân bố biểu kiến
Apparent partition coefficient (APC): Cần đánh giá ảnh hưởng của pH trong hệ tiêu hóa với phân bố giữa hai pha nước - ion-octanol.
Cơ chế hấp thu
General absorption mechanism: Thuốc hấp thu qua cơ chế khuếch tán qua màng hoặc di chuyển qua các kênh chứa nước trong hệ tiêu hóa.
Thời gian bán hủy
Pharmacokinetic parameters (t½): - \(t_{1/2} = 8\) giờ là phù hợp. - \(t_{1/2} < 1\) giờ rất khó sử dụng. - \(t_{1/2} > 8\) giờ thì không cần thiết.
Độ thanh thải
Total clearance (CL): Quyết định liều lượng sử dụng và dự đoán nồng độ thuốc trong máu.
Thể tích phân bố biểu kiến
Apparent volume of distribution (Vz): Thiết lập mối quan hệ giữa nồng độ thuốc trong máu và tổng lượng thuốc. Liên quan mật thiết với độ thanh thải và thời gian bán thải.
Sinh khả dụng tuyệt đối (F)
Absolute bioavailability (F): Hệ số gần 100% là lý tưởng khi so sánh với đường tiêm.
Hằng số tỷ lệ hấp thu nội tại Ka
Intrinsic absorption rate constant (Ka): So sánh khả năng hấp thụ với các thuốc đường uống dạng dung dịch, thường hấp thu nhanh hơn.
Nồng độ điều trị
Therapeutic concentration (Css): - Cần duy trì trong khoảng điều trị. - Nếu ( Css ) giảm, thể tích phân bố giảm, dẫn đến cần tăng thời gian bán thải.
Mô hình động học
Giải phóng thuốc
“Giải phóng thuốc” đề cập đến quá trình trong đó các chất tan thuốc di chuyển từ vị trí ban đầu trong hệ thống polyme đến bề mặt bên ngoài của polyme và sau đó đến môi trường giải phóng. Mục tiêu tập trung vào thuốc giải phóng một cách hiệu quả.
Động học phóng thuốc Drug release kinetics
Đây là một phần dược động học, nghiên cứu chi tiết về tốc độ và cơ chế thuốc giải phóng từ dạng bào chế. Nghiên cứu động học giải phóng thuốc bao gồm cả mô hình hóa.
Mô hình toán học giải phóng Mathematical modeling
Mô hình động học là một hàm toán học mô tả quá trình giải phóng hoạt chất ra khỏi hệ thống. Mục đích của mô hình toán học là đơn giản hóa quá trình giải phóng phức tạp và hiểu rõ hơn về cơ chế giải phóng của một hệ thống vật liệu cụ thể.
Polymer trong dạng bào chế hiện đại 1
Phân phối thuốc có kiểm soát (CDD) xảy ra khi một polyme, dù là tự nhiên hay tổng hợp, được kết hợp một cách thận trọng với thuốc hoặc tác nhân hoạt tính khác theo cách mà tác nhân hoạt tính được giải phóng khỏi vật liệu theo cách được thiết kế sẵn. Việc giải phóng tác nhân hoạt tính có thể không đổi trong một thời gian dài, nó có thể theo chu kỳ trong một thời gian dài hoặc nó có thể được kích hoạt bởi môi trường hoặc các sự kiện bên ngoài khác. Trong mọi trường hợp, mục đích đằng sau việc kiểm soát việc phân phối thuốc là để đạt được các liệu pháp hiệu quả hơn đồng thời loại bỏ khả năng thiếu và quá liều.
- Liên quan đến hoạt chất
- Độ tan của thuốc
- Liều lượng
- Khối lượng & kích thước phân tử
- Đặc tính hạt thuốc (Kích thước & hình dạng)
- Trạng thái vật lý
- Khả năng khuếch tán trong polymer & môi trường
- Liên quan đến polymer
- Độ nhớt
- Khả năng tạo gel
- Tỷ lệ ngậm nước
- Nhiệt chuyển trạng thái hóa rắn
- Liên quan đến công thức thuốc
- Hình dạng thuốc
- Kỹ thuật sản xuất
- Tá dược & vai trò tá dược
Mô hình toán học
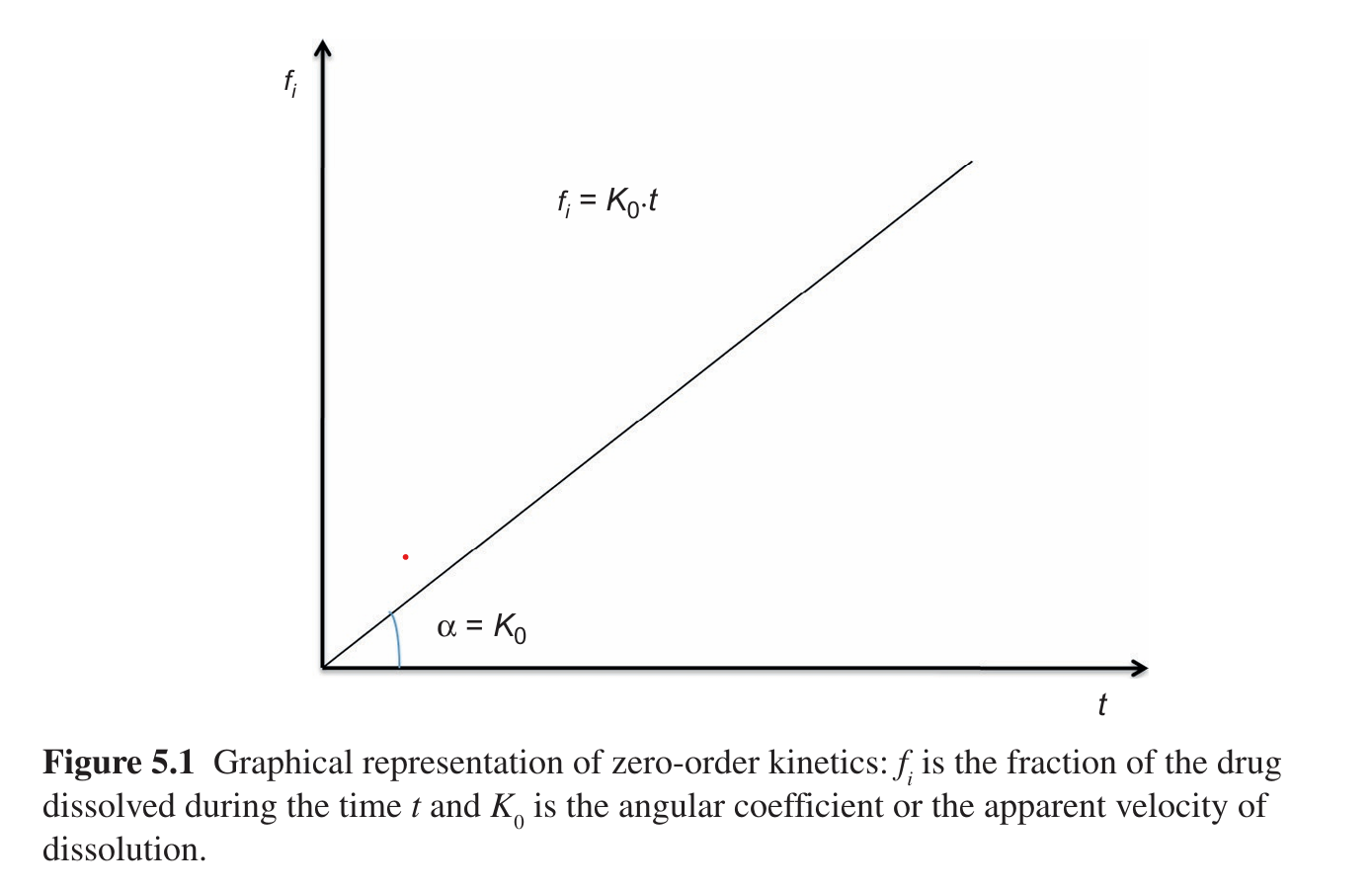
\[Q_t= Q_0 - K_0 t\]
Trong đó:
- \(Q_t\): Tổng lượng thuốc giải phóng theo tại thời điểm t
- \(W_0\): tổng lượng dược chất có trong dạng thuốc.
- \(K_0\): hằng số tốc độ giải phóng bậc 0.
Đơn vị là mg/min
Thời gian thuốc giải phóng còn một nửa có thể xác định là 0.5*\(\frac{Q_0}{K_0}\): tức là thời gian thuốc giải phóng còn một nửa phụ thuộc vào nồng độ thuốc ban đâu.
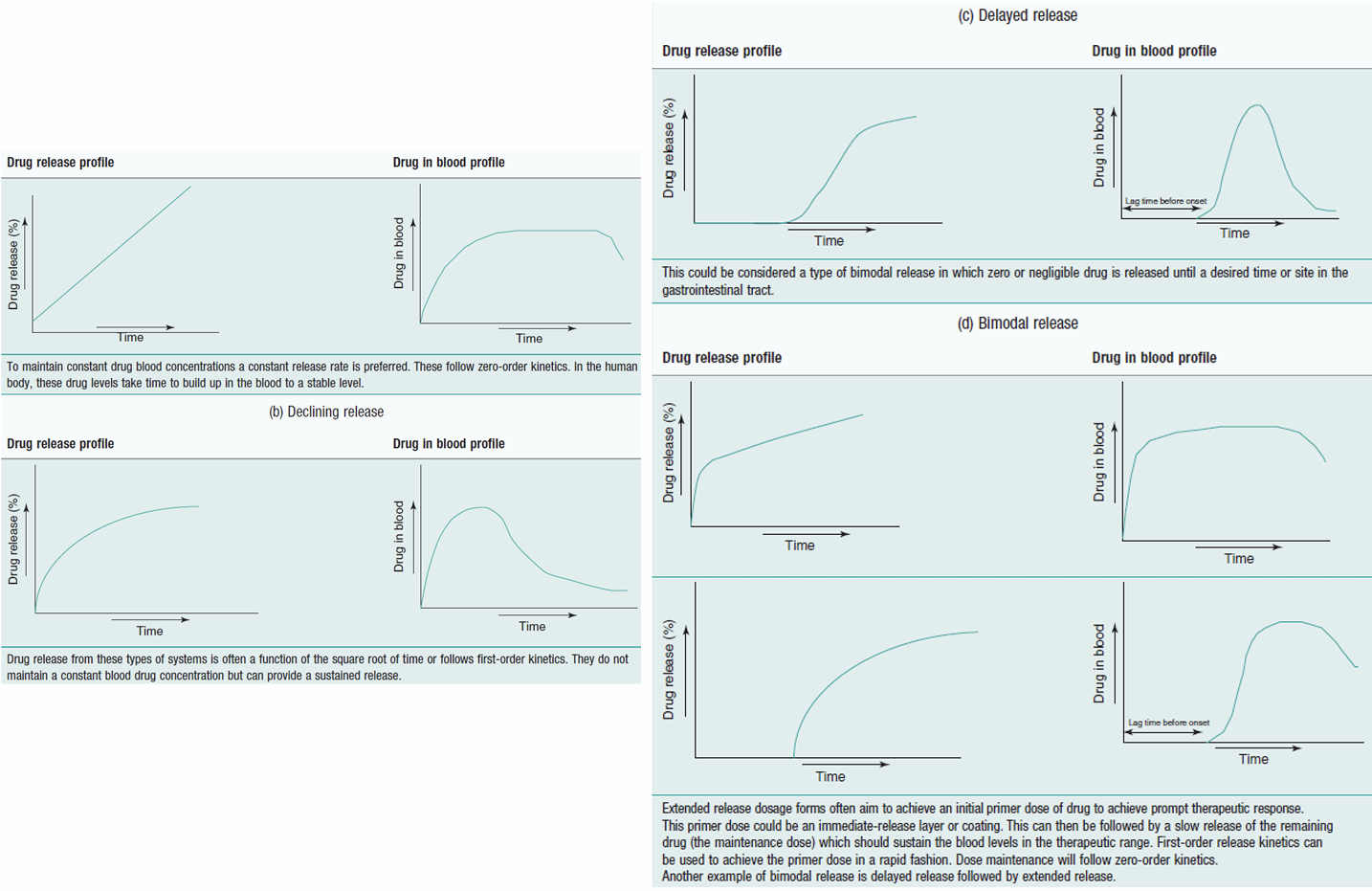
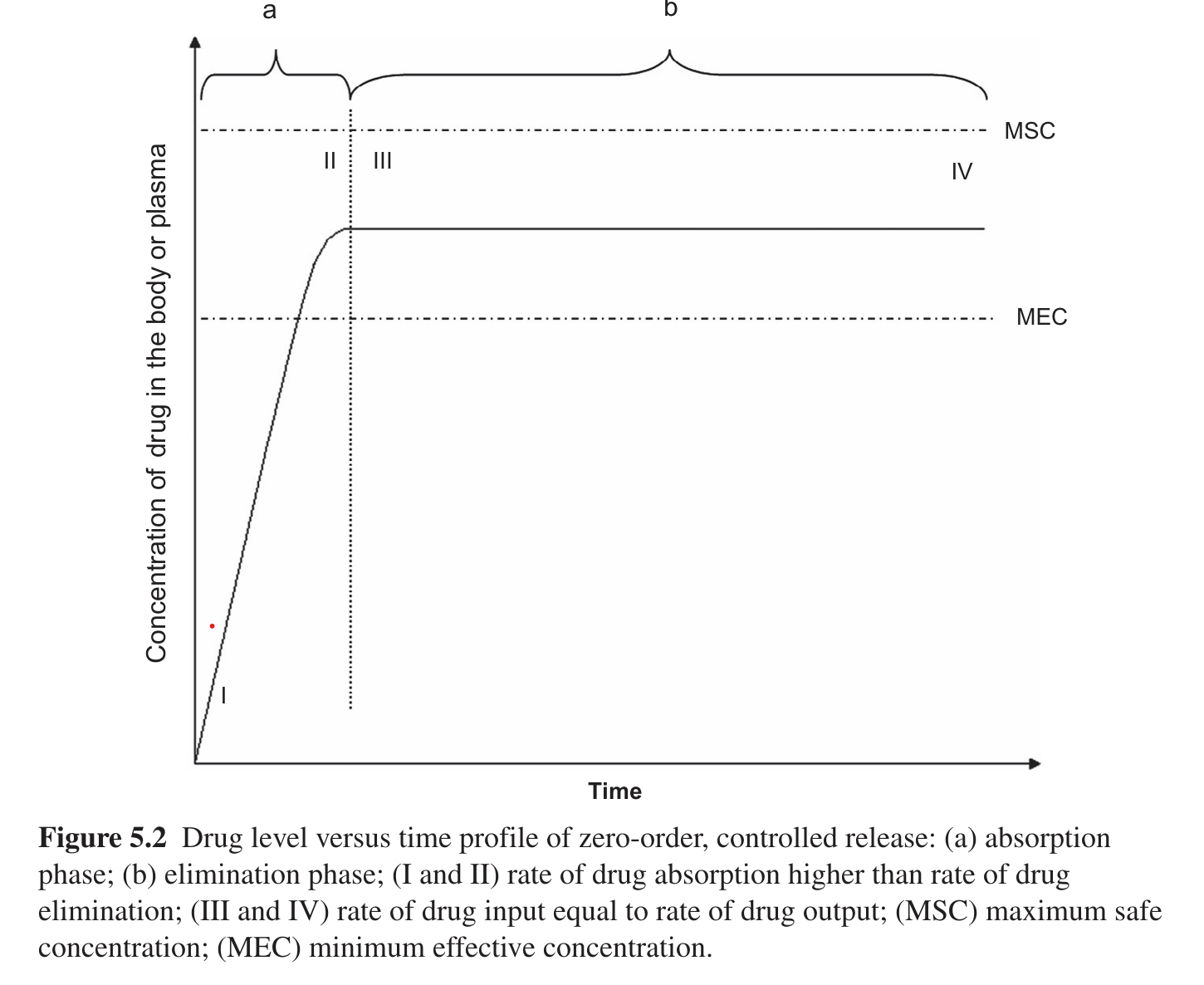
Tốc độ giải phóng dược chất trong quá trình không thay đổi theo thời gian, giải phóng chậm
Không phụ thuộc vào sự suy giảm hàm lượng dược chất trong dạng bào chế.
Ứng dụng: hệ điều trị qua da, hệ bơm thẩm thấu, viên nén cốt chứa dược chất tan chậm, hệ màng bao.
Hoạt chất: Kháng sinh, hạ đường huyết, hạ huyết áp, chống trầm cảm
Mô hình toán học
\[\frac{dC}{dt}=-Kc\]
Trong đó K là hằng số giải phóng bậc 1
Biểu thức có thể viết lại thành
\[logC = logC_0 - \frac{K_t}{2.303}\]
Với \(C_0\) là nồng độ thuốc ban đầu, là là hằng số giải phóng và t là thời gian.
Tốc độ giải phóng thuốc tuyến tính với nồng độ thuốc.
Thời gian thuốc giải phóng còn một nửa có thể tính toán 0.693/K tức là thời gian thuốc giải phóng còn một nửa độc lập.
Mô tả giải phóng dược chất từ hệ cốt thân nước, tốc độ giải phóng phụ thuộc vào lượng dược chất còn trong hệ thuốc, tốc độ giải phóng dược chất giảm dần theo thời gian.
Mô hình toán học
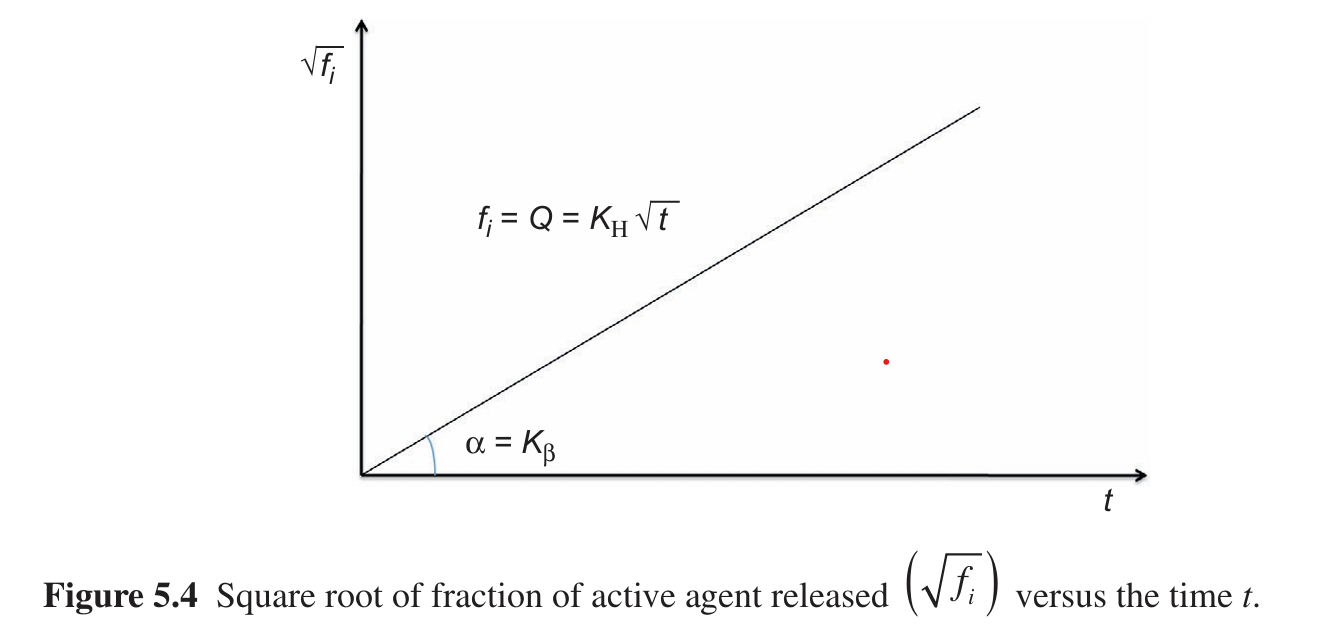
\[M= [C_s D_m (2C_0 - C_t)t]^\frac{1}{2}\] Trong đó:
- M: lượng dược chất giải phóng trên 1 đơn vị diện tích cốt có hình trụ dẹt.
- \(C_s\): nồng độ dược chất bão hòa.
- \(C_0\): lượng dược chất có trong một đơn vị thể tích cốt.
- \(D_m\): hệ số khuếch tán của dược chất trong cốt.
Hệ số \(D_m\) được quyết định bởi bản chất (cấu trúc lý, hóa) của dược chất, đặc tính lý hóa của nguyên liệu tạo cốt.
Tốc độ giải phóng phụ thuộc vào hình dạng, kích thước, khối lượng hệ cốt.
\[K t = W^\frac{1}{3}_0 - W^\frac{1}{3}_t\] Trong đó:
- \(W_0\): lượng dược chất có trong hệ thuốc tại thời điểm ban đầu.
- \(W_t\): lượng dược chất có trong hệ thuốc tại thời điểm t.
- K: hằng số biểu thị tỷ lệ diện tích bề mặt thể tích.
\[K n= \frac{M_t}{M_0}\] Trong đó:
- \(M_t, M_0\): lượng dược chất có trong hệ ở thời gian t và thời điểm ban đầu.
- K: hằng số tốc độ giải phóng.
- n: tham số, với n= 0.5 nếu theo khuếch tán Fick, n= 0.45 không theo khuếch tán Fick, 0.89 với t theo động học bậc 0, >0.89 với \(t^{n-1}\).
Hệ số tương quan
Hệ tương quan là giá trị nằm giữa -1 và 1 đề để cập về mức độ và liên hệ trực tiếp giữa các giá trị. \[R^2 = 1 - \frac{\sum^n_{i-1} (c'_i - c_i)^2}{\sum^n_{i-1} (c_i - \text{c})^2}\]
Trong đó:
- c’_i là số liệu tính toán từ hàm số đo tại thời điểm t
- c_i là số liệu thực đo tại thời điểm t
- là giá trị trung bình
Hệ số hiệu chỉnh- Coefficient of Determination
Hệ số hiệu chỉnh được sử dụng do các mô hình toán học sẽ khác nhau về các tham số bất chấp đóng góp các tham số vào mô hình. Hệ số hiệu chỉnh giúp giải quyết vấn đề này. \[R_{hc}^2 = 1 - \frac{n-1}{n-p} (1-R^2)\] Trong đó:
- n là số điểm dữ liệu quan sát được
- p là số điểm trong mô hình
Hệ số hiệu chỉnh- Coefficient of Determination
Akaike info criterion (AIC) là một phương pháp toán học để đánh giá mức độ phù hợp của một mô hình với dữ liệu được tạo ra từ mô hình đó. AIC được sử dụng trong thống kê để so sánh các mô hình khác nhau và xác định mô hình nào phù hợp nhất với dữ liệu. Điểm AIC càng thấp thì mô hình càng phù hợp
\[AIC = n \ln (\text{WSSR}) + 2P$ với $\text{WSSR} = \sum^n_{j=1} [w_j (y_j - \hat{y}_j)]\]
Trong đó:
- n là số điểm dữ liệu
- p là tham số mô hình
- WSSR: tổng bình phương phần dư của trọng số
- \(w_j\) là trọng số tùy chọn
- \(y_j\) là giá trị thực tại thời điểm j
- \(\hat{y}_j\) là giá trị tính toàn tại thời điểm j
- n số điểm lấy mẫu
Tầm quan trọng của các mô hình
- Mô hình động học giải phóng dược chất từ chế phẩm bào chế là tư liệu kỹ thuật để kiểm soát đảm bảo chất lượng các lô thuốc, phân biệt chế phẩm bào chế của các nhà sản xuất khác nhau.
- Xây dựng đường cong hòa tan, thiết lập mối liên hệ giữa mô hình in vitro và in vivo.
- Chọn phép thử độ hòa tan.
Câu hỏi lượng giá
Lượng giá
Hãy dành 15 phút để tìm hiểu vấn đề xung quanh. 02 bạn lên phân tích.
- Phân tích ưu nhược điểm của hệ thuốc giải phóng kéo dài với thuốc quy ước dựa trên cơ sở phân tích đặc điểm giải phóng dược chất.
https://dainam.edu.vn